 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
某一氧原子有如下电子构型1s22s22p2x2p2y。它有多少未成对电子?它是激发态氧吗?从该状态到基态是
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“某一氧原子有如下电子构型1s22s22p2x2p2y。它有多…”相关的问题
更多“某一氧原子有如下电子构型1s22s22p2x2p2y。它有多…”相关的问题
电子构型中,属于原子激发态的是()。
A.1s22s22p63s23p64s1
B.1s22s22p63s23p34s1
C.1s22s22p63s23p63d54s1
D.1s22s22p63s23p63d54s2
A.1s22s12p1
B.1s22S2
C.1s22s22p63s13p1
D.1S22S22p63s23p64s1
A.H2的键能等于H2的离解能
B.C-C键能是C=C键能的一半
C.根据基态电子构型,可知有多少未成对的电子,就能形成多少个共价键
D.直线形分子X-Y-Z是非极性分子
X、Y、Z、R为前四周期原子序数依次增大的元素。X原子有3个能级,且每个能级上的电子数相等;Z原子的不成对电子数在同周期中最多,且Z的气态氢化物在同主族元素的氢化物中沸点最低;X、Y、R三元素在周期表中同族。
(1)R元素基态原子的价层电子排布式为()。
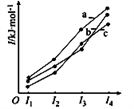
(2)下图表示X、Y、Z的四级电离能变化趋势,其中表示Y的曲线是()(填标号)。
 (3)化合物(XH2=X=O)分子中X原子杂化轨道类型分别是(),1mol(X2H5O)3Z=O分子中含有的σ键与π键的数目比为()。
(3)化合物(XH2=X=O)分子中X原子杂化轨道类型分别是(),1mol(X2H5O)3Z=O分子中含有的σ键与π键的数目比为()。
(4)Z与氯气反应可生成一种各原子均满足8电子稳定结构的化合物,其分子的空间构型为()。
(5)某R的氧化物立方晶胞结构如图所示,该物质的化学式为()。(用元素符号表示),已知该晶体密度为ρg/cm3,距离最近的原子间距离为dpm,则R的相对原子质量为()。(阿伏加德罗常数为NA)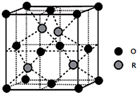
(2)写出A原子的电子排布式和元素符号();()。
(3)指出元素A在周期表中的位置()。
(4))指出元素A的最高化合价()。
(5)A的氢化物分子中共价键的类型可能有()。
①s-pσ键②p-pσ键③s-sσ键④p-pΠ键
(6)写出与A同周期未成对电子数最多的元素原子的价层电子排布式()。