题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
试用价层电子对互斥理论判断出下列分子或离子的几何构型,并指出中心原子的轨道杂化方式: (1)
试用价层电子对互斥理论判断出下列分子或离子的几何构型,并指出中心原子的轨道杂化方式: (1)
试用价层电子对互斥理论判断出下列分子或离子的几何构型,并指出中心原子的轨道杂化方式:
(1)O3;(2)NO3-;(3)AsI5;(4)NH3;(5)IF5;(6)POCl3;
查看答案
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
试用价层电子对互斥理论判断出下列分子或离子的几何构型,并指出中心原子的轨道杂化方式:
(1)O3;(2)NO3-;(3)AsI5;(4)NH3;(5)IF5;(6)POCl3;
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“试用价层电子对互斥理论判断出下列分子或离子的几何构型,并指出…”相关的问题
更多“试用价层电子对互斥理论判断出下列分子或离子的几何构型,并指出…”相关的问题
试根据价层电子对互斥理论推出下列情况下ABn型分子的几何构型:
(1)中心原子A的价层电子对数为6,配体B的个数n=4;
(2)中心原子A的价层电子对数为5,配体B的个数n=2。
并利用得出的结论判断下列分子或离子的几何构型:
(3)I3-;(4)XeF2;(5)XeF4;(6)ICl4-。
试根据价层电子对互斥理论判断下面3种三氟化物的几何构型,并用杂化轨道理论讨论其成键情况:
(1)BF3;(2)NF3;(3)BrF3
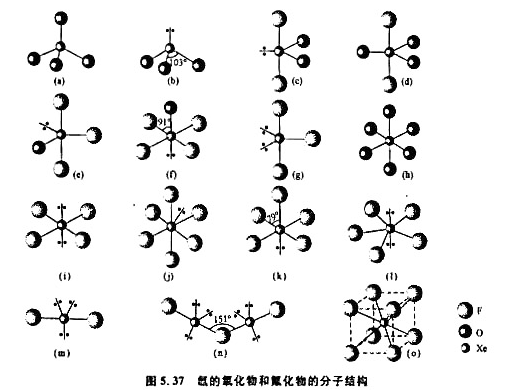
图5.37示出氙的氟化物和氧化物的分子(或离子)结构。
(1)根据图形及VSEPR理论,指出分子的几何构型名称和所属点群;
(2)Xe原子所用的杂化轨道;
(3)Xe原子的表观氧化态;
(4)已知在XeF2,XeF4,加合物晶体中,两种分子的构型与单独存在时的几何构型相同,不会相互化合成XeF2,从中说明什么问题?